Tổng hợp kiến thức về một số muối quan trọng – Hóa học 9
Một số muối quan trọng có trong chương trình Hóa học 9 bài 10. Đây là một trong những nội dung trọng tâm trong chương trình mà học sinh cần nắm vững. Vì vậy, một số lý thuyết muối quan trọng là gì? Các dạng bài tập về một số muối quan trọng 9? Hay một số bài tập quan trọng về muối cần lưu ý?… Trong bài viết sau, Tip.edu.vn sẽ giúp bạn tổng hợp kiến thức về một số chủ đề quan trọng về muối, cùng tham khảo nhé!
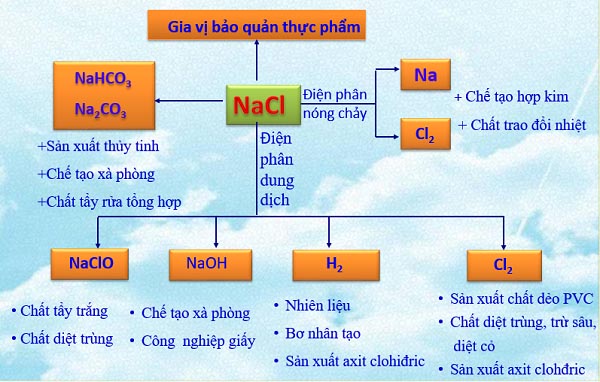
Muối natri clorua (NaCl)
Trạng thái tự nhiên của NaCl
- Natri clorua (NaCl) tồn tại ở dạng hòa tan trong nước biển.
- Để nước biển bay hơi ta được chất rắn là hỗn hợp của nhiều muối, thành phần chính là NaCl
- Trong (1m ^ {3} ) nước biển có hòa tan khoảng 27 kg NaCl, 5 kg MgCl, 1 kg (CaSO_ {4} ) và một lượng nhỏ các muối khác.
- Ngoài ra, trong lòng đất còn có một khối lượng muối natri clorua (NaCl) kết tinh được gọi là muối mỏ.
- Các mỏ muối bắt nguồn từ các hồ nước mặn đã khô cạn qua hàng triệu năm.
Làm thế nào để khai thác NaCl?
- Ở những nơi có biển hoặc hồ muối, người ta tách được NaCl từ nước muối trên. Để nước muối bay hơi từ từ, cho muối kết tinh.
- Ở những nơi có mỏ muối, người ta đào đường hầm hoặc giếng sâu xuống mỏ muối để lấy muối lên.
- Muối mỏ sau khi khai thác được nghiền nhỏ và tinh luyện để có muối sạch.
Ứng dụng của (NaCl)
Muối ăn NaCl có nhiều ứng dụng trong đời sống và sản xuất, nó được dùng để:
- Nêm gia vị và bảo quản thực phẩm. Muối iốt là muối ăn NaCl có trộn một ít (KIO_ {3} + KI )
- Là nguyên liệu để sản xuất: (Na, NaOH, H_ {2}, Cl_ {2}, Na_ {2} CO_ {3}, ) Nước Javen (NaClO),…
Kali nitrat ( (KNO_ {3} ))
Tính chất của Kali nitrat
- (KNO_ {3} ) là chất rắn, hòa tan nhiều trong nước, tỏa nhiệt khi hòa tan.
- (KNO_ {3} ) bị nhiệt phân:
(2KNO_ {3} overset {t ^ { circle}} { rightarrow} 2KNO_ {2} + O_ {2} )
Ứng dụng của Kali nitrat
- Dùng để chế tạo thuốc nổ.
- Làm phân bón.
- Bảo quản thực phẩm công nghiệp.
Bài tập về một số muối quan trọng
Bài 1: Phân biệt các dung dịch sau: (NaCl, MgCl_ {2}, KNO_ {3}, Na_ {2} SO_ {4} )
Giải pháp:
Lần 1: Sử dụng (BaCl_ {2} ):
- (Na_ {2} SO_ {4} ): Xuất hiện kết tủa trắng
(Na_ {2} SO_ {4} + BaCl_ {2} rightarrow BaSO_ {4} + 2NaCl )
- (NaCl, MgCl_ {2}, KNO_ {3} ): Không có hiện tượng gì
Lần 2: Dùng NaOH
- (MgCl_ {2} ): Xuất hiện kết tủa trắng
(MgCl_ {2} + NaOH rightarrow Mg (OH) _ {2} + NaCl )
Lần 3: Sử dụng (AgNO_ {3} )
- NaCl: Xuất hiện kết tủa trắng
(NaCl + AgNO_ {3} rightarrow AgCl + NaNO_ {3} )
- (KNO_ {3} ): Không có hiện tượng gì
Bài 2: Hòa tan vào nước 0,325ga hỗn hợp 2 muối natri clorua và kali clorua. Thêm vào dung dịch này một lượng dư dung dịch bạc nitrat – Kết tủa bạc clorua thu được có khối lượng 0,717 g. Tính thành phần phần trăm của mỗi chất trong hỗn hợp.
Giải pháp:
Gọi (m_ {NaCl} ) là x và (m_ {KCl} ) là y chúng ta có phương trình:
x + y = 0,325 (đầu tiên)
Phương trình hóa học:
(NaCl + AgNO_ {3} rightarrow AgCl + NaNO_ {3} )
(KCl + AgNO_ {3} rightarrow AgCl + KNO_ {3} )
Dựa vào hai phương trình hóa học ta tìm được khối lượng AgCl trong mỗi phản ứng:
(m ‘_ {AgCl} = x. frac {M_ {AgCl}} {M_ {NaCl}} = frac {143} {58,5} .x = 2,444x )
(m_ {AgCl} = y. frac {M_ {AgCl}} {M_ {KCl}} = frac {143} {74,5} .y = 1,919y )
( Rightarrow m_ {AgCl} = 2.444x + 1.919y = 0.717 ) (2)
Từ (1) và (2) ta có hệ phương trình:
( left { begin {matrix} x + y = 0.325 \ 2.444x + 1.919y = 0.717 end {matrix} right Rightarrow left { begin {matrix} x = 0.178 \ y = 0,147 end {matrix} right. )
Cho nên:
% NaCl = ( frac {0,178} {0,325} .100 )% = 54,76%
% KCl = 100% -% NaCl = 100% – 54,76% = 45,24%.
Vậy trong hỗn hợp: NaCl chiếm 54,76%, KCl chiếm 45,24%
Bài 3: Có các muối sau: (CaCO_ {3}, CaSO_ {4}, Pb (NO_ {3}) _ {2}, NaCl ). Muối nào ở trên:
- Không được phép trong nước uống vì độc tính của nó?
- Không độc mà cũng không vào nước vì có vị mặn?
- Không tan trong nước, nhưng bị phân hủy ở nhiệt độ cao?
- Rất ít tan trong nước và khó bị phân hủy ở nhiệt độ cao?
Giải pháp:
- Không được phép dùng trong nước uống vì độc tính: (Pb (NO_ {3}) _ {2} )
- Không độc nhưng cũng không nên để trong nước uống vì có vị mặn: NaCl
- Không tan trong nước nhưng bị phân hủy ở nhiệt độ cao: (CaCO_ {3} )
Phương trình hóa học:
(CaCO_ {3} overset {t ^ { circle}} { rightarrow} CaO + CO_ {2} )
4. Rất ít tan trong nước và khó bị phân hủy ở nhiệt độ cao: (CaSO_ {4} )
Xem thêm >>> Tìm hiểu lý thuyết và bài tập về một số cơ sở quan trọng
Xem thêm >>> Lý thuyết và Các dạng bài tập về chủ đề một số oxit quan trọng
Xem thêm >>> Một số axit quan trọng: Lý thuyết và Các dạng bài tập
Như vậy, Tip.edu.vn đã giúp các bạn tổng hợp kiến thức về chủ đề Một số muối quan trọng, lý thuyết và bài tập về một số muối quan trọng. Hi vọng bài viết đã cung cấp cho các bạn những kiến thức bổ ích, phục vụ cho quá trình học tập và nghiên cứu về một số loại muối quan trọng. Chúc may mắn với các nghiên cứu của bạn!
Xem thêm nhiều bài viết hay về Hỏi Đáp Hóa Học
