Kim loại tác dụng với dung dịch muối: Lý thuyết và Bài tập nâng cao
Trong chương trình học hóa học lớp 9, kim loại phản ứng với dung dịch muối là chuyên đề quan trọng mà các em cần nắm vững. Vậy kim loại phản ứng được với dung dịch muối theo lý thuyết nào? Bài tập kim loại tác dụng với muối nâng cao như thế nào? Cách viết phương trình kim loại phản ứng với dung dịch muối?… Trong bài viết dưới đây, Tip.edu.vn sẽ tổng hợp kiến thức về chủ đề Kim loại tác dụng với dung dịch muối và một số bài tập tiêu biểu, các bạn cùng tham khảo nhé!
Thuyết kim loại phản ứng với muối
- Phản ứng của kim loại với dung dịch muối còn được gọi là phản ứng thủy luyện.
- Khi cho một kim loại vào dung dịch muối, hiện tượng sau sẽ xảy ra:
* Nếu kim loại là Na, K, Ba, Ca (hoặc một số kim loại kiềm, kiềm thổ khác) thì kim loại phản ứng với nước tạo thành dung dịch kiềm và hiđro. Chỉ khi đó kiềm mới phản ứng được với dung dịch muối (phản ứng chỉ xảy ra khi sau phản ứng có kết tủa, bay hơi hoặc chất điện li yếu).
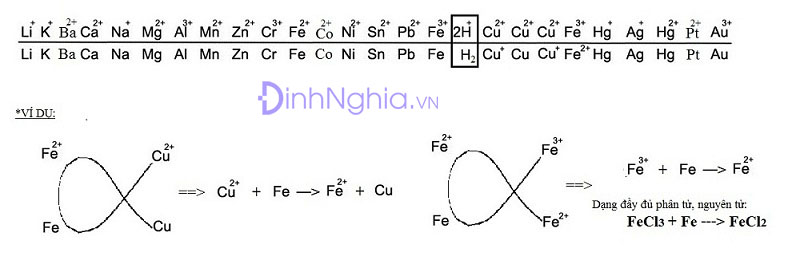
* Với các kim loại khác khi cho vào dung dịch muối thì phản ứng tuân theo quy tắc anpha ( ( alpha )). Kim loại đứng trước đẩy kim loại đứng sau ra khỏi dung dịch. Tuy nhiên, chúng ta cũng cần chú ý đến các cặp oxi hóa khử của sắt.
- Trong trường hợp có nhiều kim loại hoặc dung dịch chứa nhiều muối thì áp dụng quy tắc anpha dài trước, áp dụng quy tắc anpha ngắn. Trong quá trình làm bài tập này, chúng em chú ý vận dụng phương pháp tăng giảm khối lượng, phương pháp bảo toàn e, phương pháp so sánh….
Cơ chế phản ứng của kim loại với dung dịch muối:
Kim loại phản ứng với dung dịch muối sẽ cho cơ chế phản ứng sau:
- Đối với dạng toán về kim loại phản ứng với muối, cơ chế phản ứng sẽ tuân theo nguyên tắc ( alpha ).
- Dãy điện hóa của kim loại:
Kim loại phản ứng với muối nitrat
Lý thuyết về kim loại phản ứng với dung dịch muối nitrat: Muối nitrat có tất cả các tính chất hoá học chung của muối nên kim loại có thể phản ứng với muối nitrat.
- Hoạt động nếu kim loại là chất khử mạnh hơn kim loại trong muối ( rightarrow ) muối mới + kim loại mới.
(Cu + 2AgNO_ {3} rightarrow Cu (NO_ {3}) _ {2} + 2Ag )
Kim loại phản ứng với axit
Kim loại phản ứng với loại 1. axit
- Kim loại + Axit Loại 1 ( rightarrow ) Muối + (H_ {2} )
Tình trạng:
- Kim loại là kim loại đứng trước H trong dãy phản ứng.
Đặc điểm:
- Muối tạo thành có hóa trị thấp (đối với kim loại có nhiều hóa trị)
Ví dụ:
(Fe + 2HCl ngay lập tức FeCl_ {2} + H_ {2} )
Kim loại phản ứng với loại 2. axit
- Kim loại + axit loại 2 ( rightarrow ) Muối + sản phẩm khử
Đặc điểm:
- Phản ứng xảy ra với tất cả các kim loại (trừ Au, Pt).
- Là muối có hóa trị cao nhất (đối với kim loại đa hóa trị).
Các dạng bài tập kim loại tác dụng với muối nâng cao
Dưới đây là một số dạng bài tập tác dụng với muối của kim loại lớp 9 cho các bạn tham khảo:
Dạng 1: Kim loại phản ứng với một muối
Phương pháp giải quyết:
- Phương trình tổng quát
Kim loại + Muối ( rightarrow ) Muối mới + Kim loại mới
- Nếu bài toán cho khối lượng lá kim loại tăng hay giảm, ta áp dụng công thức sau:
- Khối lượng lá kim loại tăng lên so với trước khi nhúng, ta có:
Khối lượng kim loại bám vào – khối lượng kim loại nóng chảy = độ tăng khối lượng
- Khối lượng lá kim loại giảm so với trước khi nhúng, ta có:
Khối lượng kim loại bám vào – khối lượng kim loại nóng chảy = khối lượng giảm
- Nếu bài toán cho khối lượng lá kim loại tăng hoặc giảm x% thì ta áp dụng công thức sau:
- Khối lượng lá kim loại tăng x% so với trước khi nhúng ta có:
Khối lượng kim loại bám vào – khối lượng kim loại nóng chảy = (m_ {bd}. Frac {x} {100} )
- Khối lượng lá kim loại giảm x% so với trước khi nhúng, ta có:
Khối lượng kim loại nóng chảy – khối lượng kim loại gắn vào = (m_ {bd}. Frac {x} {100} )
Ví dụ 1: Nhúng thanh kim loại M vào 100 ml dung dịch (FeCl_ {2} ) 0,5M. Sau khi phản ứng hoàn toàn, khối lượng thanh kim loại giảm 0,45g. Kim loại M là gì?
Giải pháp:

Dạng 2: Một kim loại phản ứng với hỗn hợp các muối
- Phương pháp giải quyết
- Trong bài toán này phải xác định rõ cation kim loại của muối nào có tính oxi hóa mạnh hơn để xác định bậc của phản ứng xem chất nào phản ứng trước, chất nào phản ứng sau. Quy tắc là kim loại sẽ phản ứng với ion kim loại có tính oxi hóa mạnh trước.
Ví dụ: Cho Mg (z mol) phản ứng với dung dịch chứa đồng thời (FeSO_ {4} ) a mol và (CuSO_ {4} ) b mol thì ion (Cu ^ {2 +} ) sẽ bị khử trước đây và loại vấn đề này thường được giải quyết trong 3 trường hợp:
(Mg + CuSO_ {4} rightarrow MgSO_ {4} + Cu ) (đầu tiên)
(Mg + FeSO_ {4} rightarrow MgSO_ {4} + Fe ) (2)
Trường hợp 1: Chỉ xảy ra phản ứng (1). Tức là phản ứng (1) xảy ra vừa đủ thì dung dịch sau phản ứng gồm: (MgSO_ {4}, FeSO_ {4} ) không phản ứng và chỉ có Cu.
Trường hợp 2: Cả hai phản ứng (1) và (2) đều xảy ra vừa đủ. Tức là dung dịch thu được chỉ có (MgSO_ {4} ) và chất rắn gồm Cu và Fe.
Trường hợp 3: Phản ứng (1) xảy ra toàn bộ và phản ứng (2) xảy ra một phần, bây giờ có 2 khả năng xảy ra nữa
– Sau phản ứng (2) (FeSO_ {4} ) còn lại:
Số mol (FeSO_ {4} ) dư là (a – x) mol trong đó x là số mol (FeSO_ {4} ) tham gia phản ứng (2).
Khi đó, dung dịch sau phản ứng gồm: (MgSO_ {4}, FeSO_ {4} ) dư và chất rắn gồm Cu và Fe.
– Sau phản ứng (2) Mg dư (bài toán chưa hoàn thành):
Số mol Mg dư là z – (a + b) trong đó (a + b) là số mol Mg phản ứng với 2 muối.
Khi đó dung dịch sau phản ứng gồm: (MgSO_ {4} ) và chất rắn gồm Cu, Fe và Mg dư.
Ví dụ 2: Cho 2,24 gam bột sắt vào 200 ml dung dịch hỗn hợp gồm (AgNO_ {3} ) 1M và (Cu (NO_ {3}) _ {2} ) 0,5M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y. Giá trị của m là bao nhiêu?
Giải pháp:

Dạng 3: Hỗn hợp kim loại phản ứng với một muối
Phương pháp giải chung:
- Với bài toán này khi giải chúng ta phải chú ý khi cho kim loại vào dung dịch muối thì kim loại nào sẽ phản ứng trước. Đến đây, chúng ta phải nhớ lại bảng điện hóa của các kim loại để xem kim loại nào có khả năng khử mạnh nhất trong các kim loại. Khi cho các kim loại vào cùng một dung dịch muối, kim loại có tính khử mạnh hơn sẽ phản ứng trước và cứ tiếp tục như vậy.
Ví dụ: Cho hỗn hợp gồm Mg (a mol) và Fe (b mol) phản ứng với dung dịch chứa x mol (CuSO_ {4} ) thì Mg sẽ phản ứng trước, khi Mg hết (CuSO_ {4} ) vẫn , phản ứng với Fe.
Sự cố này cũng có 3 trường hợp có thể xảy ra theo thứ tự sau:
(Mg + CuSO_ {4} rightarrow MgSO_ {4} + Cu ) (đầu tiên)
(Fe + CuSO_ {4} rightarrow FeSO_ {4} + Cu ) (2)
Trường hợp 1: Chỉ xảy ra phản ứng (1).
Khi đó dung dịch chỉ có MgSO4 và chất rắn gồm Cu và Fe còn nguyên và có thể có Mg dư.
Trường hợp 2: Cả hai phản ứng (1) và (2) đều xảy ra vừa đủ.
Khi đó dung dịch gồm (MgSO_ {4} ) và (FeSO_ {4} ) và chất rắn chỉ chứa Cu.
Trường hợp 3: Phản ứng (1) hoàn toàn và phản ứng (2) là từng phần và thường có 2 khả năng
- Sau phản ứng còn dư Fe (phản ứng không hoàn toàn)
(Mg + CuSO_ {4} rightarrow MgSO_ {4} + Cu ) (đầu tiên)
(Fe + CuSO_ {4} rightarrow FeSO_ {4} + Cu ) (2)
- Dung dịch sau phản ứng gồm: (MgSO_ {4} ): a mol, (FeSO_ {4} ): x mol
- Chất rắn sau phản ứng gồm: Cu (a + x) mol và Fe dư: (b – x) mol
- Sau phản ứng (CuSO_ {4} ) còn dư.
(Mg + CuSO_ {4} rightarrow MgSO_ {4} + Cu ) (đầu tiên)
(Fe + CuSO_ {4} rightarrow FeSO_ {4} + Cu ) (2)
- Dung dịch sau phản ứng gồm: (MgSO_ {4} ): a mol, (FeSO_ {4} ): x mol, (CuSO_ {4} ) dư: [x – (a + b)] mol
- Chất rắn sau phản ứng gồm: Cu (a + b) mol.
Dạng 4: Hỗn hợp kim loại phản ứng với hỗn hợp các muối
Ví dụ 3: Cho hỗn hợp gồm 1,2 mol Mg và x mol Zn vào dung dịch chứa 2 mol (Cu ^ {2 +} ) và 1 mol (Ag ^ {+} ) cho đến khi các phản ứng xảy ra hoàn toàn. thì thu được dung dịch chứa ba ion kim loại. Giá trị của x là bao nhiêu?
Giải pháp:
Theo định luật bảo toàn êlectron, ta có:

Áp dụng định luật bảo toàn êlectron ta có:
(2,4 + 2x = 5 Mũi tên trái x = 1,3 , (mol) )
Xem thêm >>> Benzen là gì? Tổng hợp kiến thức về benzen 9 và Các dạng bài tập
Xem thêm >>> Tổng hợp kiến thức về một số muối quan trọng – Hóa học 9
Như vậy, Tip.edu.vn đã giúp các bạn tổng hợp lý thuyết về kim loại tác dụng với dung dịch muối, bài tập nâng cao kim loại tác dụng với muối, cách viết phương trình kim loại tác dụng với dung dịch muối cũng như các kiến thức về kim loại phản ứng với axit hay kim loại phản ứng với muối nitrat. Hi vọng với những thông tin trên, các bạn đã tích lũy được những kiến thức bổ ích về chủ đề kim loại phản ứng với dung dịch muối. Chúc may mắn với các nghiên cứu của bạn!
Từ khóa: Lý thuyết về kim loại tác dụng với muối, bài tập kim loại tác dụng với muối khó, bài tập kim loại tác dụng với muối nâng cao, bài tập kim loại tác dụng với muối lớp 9, bài tập trắc nghiệm kim loại tác dụng với muối, viết phương trình kim loại phản ứng với muối dung dịch, kim loại phản ứng với muối nitrat, kim loại phản ứng với axit, kim loại phản ứng với dung dịch muối
Xem thêm nhiều bài viết hay về Hỏi Đáp Hóa Học
